1.2 燃料电池简介
燃料电池是继水力发电、火力发电和核能发电后的第四代新型发电技术[3,4]。它是一种能直接化学能转化为电能的高效绿色发电装置,在这过程中不发生燃烧。燃料电池由阳极、电解质、阴极及其它辅助结构等几部分构成。由于能量转化效率不受Carnot循环的限制,燃料电池的能量转化效率很高,实际应用过程中可达40%到60%,远高于Carnot热机的最大值50%[5],是普通内燃机的2~3倍,燃料利用率大幅提高。电池的能量来源于不断供给的燃料中,燃料的选择范围大。因此,只要燃料和氧气持续地供应,电能就能稳定而不断地获得[6]。
燃料电池按工作温度可分为中低温燃料电池和高温燃料电池[7]。根据电解质的性质,燃料电池可以划分为五大类[5,8]:碱性燃料电池(Alkaline Fuel Cell, AFC)、磷酸燃料电池(Phosphorous Acid Fuel Cell, PAFC)、熔融碳酸盐燃料电池(Molten Carbonate Fuel Cell, MCFC)、质子交换膜燃料电池(Proton Exchange Membrane Fuel Cell, PEMFC)和固体氧化物燃料电池(Solid Oxide Fuel Cell, SOFC)。目前,燃料电池的研究热点为SOFC和PEMFC[5]。
1.3 固体氧化物燃料电池(SOFC)概述
1.3.1 SOFC的工作原理
固体氧化物燃料电池(SOFC)是在20 世纪八十年代迅速发展起来的绿色能源技术,属于第三代燃料电池[5,7]。固体氧化物燃料电池是一种全固态的化学发电装置,它能直接将物质的化学能转化成电能,在这过程中不发生燃烧或任何剧烈的化学反应,是一种高效的、对环境友好的发电方式。SOFC主要由两大部分组成——电极和电解质,电极包括疏松多孔的阴极和阳极,中间用致密的电解质层隔开。SOFC的工作原理如图1.1所示,工作时将氢气或其他燃料气源源不断地通入阳极,将空气或氧气通入阴极。阳极侧的H2失去电子发生氧化反应变成H+,并与电解质中的晶格氧结合生成H2O,在电解质晶格中产生氧空位,阳极多余的电子沿着外电路向阴极转移;阴极侧的O2在阴极表面吸附并分解成氧原子,然后扩散到电极-电解质-气体的三相界面(TPB),并与从外电路过来的电子结合发生还原反应生成O2-,O2-通过电解质内的氧空位迁移到阳极侧与H+结合生成H2O,从而产生直流电[9,10]。
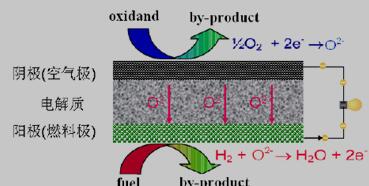
图1.1 SOFC工作原理示意图
1.3.2 SOFC的结构类型
目前,SOFC单电池按几何结构划分,被研究最多的主要有两种型式:管型(图1.2)和平板型(图1.3)。最早发展且目前比较成熟的是管型SOFC。管型SOFC的管壁从内到外分别由多孔的支撑管、阴极、固体电解质薄膜及阳极构成[11,12]。其突出优点是易于密封和实现电池堆的集成化设计,但不足之处是制造成本较高和功率密度较低[5,6]。平板型SOFC类似于“三明治”,由阴极、固体电解质和阳极依次叠加烧结成平板状,然后两面加上电极连接板层压制而成。其优点是制作工艺简单、成本较低、电流收集方便同时功率密度高,因而逐渐成为SOFC的发展趋势。但平板型SOFC的缺点也比较突出:高温密封困难、各组件的热匹配性差、抗热循环性能较差,大尺寸的单电池制作较困难[5,6]。 钙钛矿型阴极材料LSMM的合成改性及其在SOFC中的应用(2):http://www.751com.cn/huaxue/lunwen_30518.html

