- 上一篇:微球粉体碱式碳酸铜的制备及生产设计+图纸
- 下一篇:烟气低温脱硝催化剂的制备及性能研究
2.1.3 本实验原料参数13
2.2 反应条件的筛选14
2.2.1 碱的筛选14
2.2.2 双氮配体的考察14
2.2.3 反应溶剂的考察15
2.2.4 溴化反应的底物拓展16
2.2.5 二酮类配体的考察17
2.2.6 配体的进一步考察17
2.2.7 铜催化剂的考察18
3.全文总结
3.1总结20
致谢.21
参考文献.22
附录.25
1. 前言
1.1引言
有机合成化学是一门研究化学键断裂与形成的实验科学,其中,C-C键、C-O键、C-N键、C-X键的形成在有机合成中占有非常重要的地位。长久以来,化学家一直在寻找合适的前体和温和的反应条件来构建这些化学键,并取得了极大的发展。有机硼化合物以其低毒性和稳定性,越来越受到化学家的青睐,在工业合成上也具有很高的应用价值。其中,关于芳基硼酸的化学转化已经有较多的报道,目前已经发展了相应的反应体系实现C-B键向C-C键、C-O键 、C-N键 、C-S键 和C-X键的转化。但是传统的反应体系具有一定局限性,比如需要昂贵的催化剂,反应条件剧烈,官能团的兼容性和底物的普适性较差等。近年来,发展高效的反应体系实现C-B键向其它化学键的转化受到化学工作者的持续关注,并取得了长足的发展。
自从日本化学家Suzuki和Miyaura实现钯催化芳基硼酸与卤代芳烃的交叉偶联反应以来,这个领域受到越来越多的关注,并对该方法进行不断地改进和升华,目前已经成为有机合成中不可或缺的重要工具。该反应在学术界和工业界都得到了广泛的应用,Suzuki教授也因为其极大贡献获得了2010年的诺贝尔奖。随着研究的不断深入,目前已经发展了多种C-B键向C-C键、C-O键、C-N键、C-S键和C-X键的转化方法,从简单的芳基硼酸出发合成一系列芳胺、酚、芳醚和卤代芳烃等重要有机化合物(图1-1)。
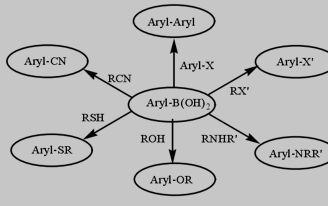
图1-1硼酸基官能团向多种官能团的转化
1.2 C-B键向C-C键的转化
1.2.1 C-B向C-Csp转化,芳基硼酸的氰基化反应
腈基官能团广泛的存在于有机药物、农药等分子当中,许多含有该官能团的有机分子均表现相互非常高的生物活性 ,同时,腈基官能团可以方便的转化为醛基、酮基、胺基、羧酸和酯基等其他一系列有用的官能团 ,具有非常丰富的反应化学。而芳基腈化合物作为一类重要的有机合成中间体,受到化学工作者的广泛关注。经典的合成芳基腈类化合物的方法是Rosenmund-ovn Braun反应 和Sandmeyer反应,但是这些反应存在反应条件差,官能团兼容性差和原子经济性差等一系列问题。
2010年,Hartwig小组 报道了金属铜盐参与的芳基硼酸的氰基化反应,该反应采用Zn(CN)2作为氰基化试剂,CsF作为碱,甲醇和水为共溶剂,能够以58%–70%的产率得到对应的氰基化产物,同时他们还考察了其它一系列的氰基来源,结果显示亚铁氰化钾等试剂不能实现该类转化,提出了合理的反应机理,对之后的研究提供了宝贵的参考价值。
-
钯催化下咪唑并[1',2'1,5]吡...
-
含脲基的金属-有机框架材...
-
纳米Trögersbase衍生物催化...
-
1,7-二(N-(吡啶-2-甲基))胺甲...
-
3,5-二氯-2,4-二羟基苯乙酮...
-
NHC-Pd化合物在催化溴代苯...
-
咪唑并邻菲罗啉-亚铜-1,...
当代大学生慈善意识研究+文献综述
乳业同业并购式全产业链...
电站锅炉暖风器设计任务书
大众媒体对公共政策制定的影响
java+mysql车辆管理系统的设计+源代码
十二层带中心支撑钢结构...
河岸冲刷和泥沙淤积的监测国内外研究现状
中考体育项目与体育教学合理结合的研究
酸性水汽提装置总汽提塔设计+CAD图纸
杂拟谷盗体内共生菌沃尔...